特殊醫學用途配方食品注冊辦法詳解
2016-06-06
國家食品藥品監督管理總局頒布的《特殊醫學用途配方食品注冊管理辦法》將于2016年7月1日正式實施,特殊醫學用途配方食品的申報、生產、流通都將被規范管理。
《辦法》中規定,只有具備以下全部條件的企業,才能有資質生產并申請注冊特殊醫學用途配方食品:
(1)具備所生產特殊醫學用途配方食品相適應的研發、生產和檢驗能力;
(2)應當設立獨立的特殊醫學用途配方食品研發機構,并配備專職人員和設備;
(3)執行《特殊醫學用途配方食品良好生產規范》(GB29923-2013);
(4)執行《食品安全管理體系食品鏈中各類組織的要求》(GB/T22000-2006);
(5)具有標準規定的全部項目檢驗能力。
詳解注冊辦法
【一、注冊機構】
國家食品藥品監督管理總局食品審評機構負責特殊醫學用途配方食品注冊的審評工作。
【二、注冊流程】
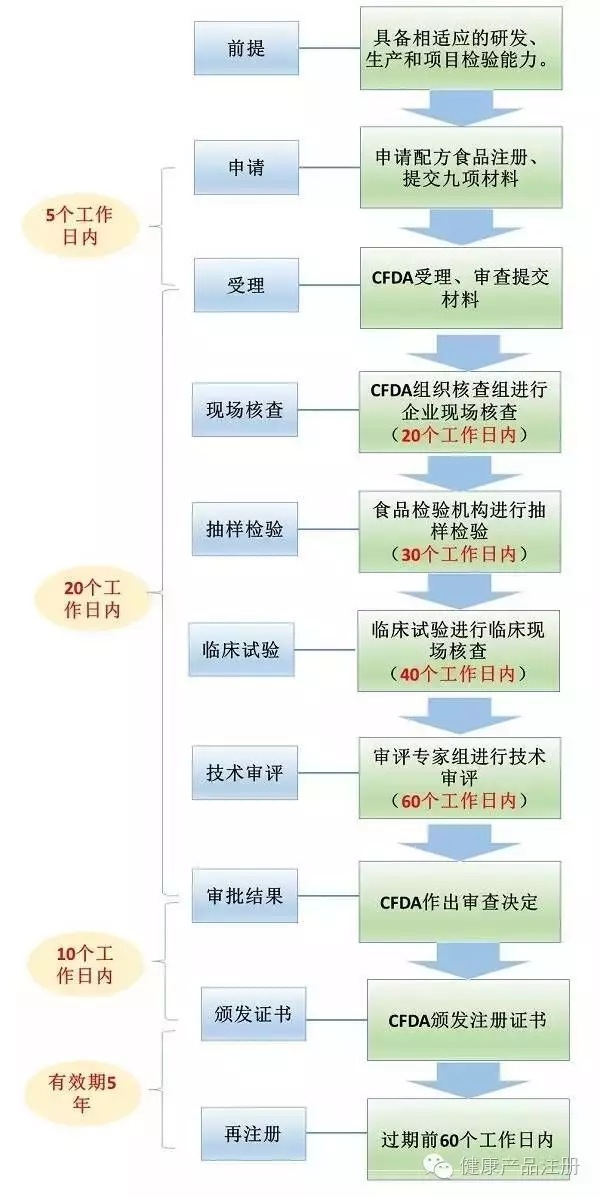
【三、注冊范圍】

【四、申請材料】
(一)特殊醫學用途配方食品注冊申請書;
(二)產品研發報告和產品配方設計及依據;
(三)生產工藝資料;
(四)產品質量的標準要求;
(五)產品標簽、說明書設計樣稿;
(六)試驗樣品檢驗報告;
(七)研發、生產和檢驗能力證明材料;
(八)其他表明產品安全性、營養充足性的材料;
(九)特定全營養配方食品注冊,還應提交臨床試驗報告。
【五、證書內容】
(一)產品名稱
(二)企業名稱、法定代表人、生產地址
(三)注冊號及有效期
(四)產品類別
(五)產品配方
(六)生產工藝
(七)產品標簽、說明書
【六、再注冊】
特殊醫學用途配方食品注冊證書有效期為5年。有效期屆滿,需要繼續生產或進口的,應當在有效期屆滿60日前,向國家食品藥品監督管理總局提出再注冊申請,并提交下列材料:
(一)特殊醫學用途配方食品再注冊申請書;
(二)特殊醫學用途配方食品注冊證書;
(三)5年內產品生產、銷售、監督抽檢情況,對產品不合格情況應當做出說明;
(四)5年內產品使用情況及不良反應情況總結。
【七、不予再注冊的情況】
(一)注冊后未取得生產許可的;
(二)未在規定時間內提出再注冊申請的;
(三)注冊產品一年內在省級以上監督抽檢中出現2次及以上不合格的;
(四)企業未能保持生產、研發、檢驗能力的;
(五)企業未按要求記錄生產銷售信息的;
(六)其他不符合有關規定的情形。